La respiration se définit comme l’ensemble des fonctions assurant l’échange oxygène – gaz carbonique entre l’atmosphère et les cellules de l’organisme.
La circulation du sang s’effectue à travers deux systèmes : la circulation pulmonaire (ou petite circulation) et la circulation systémique (ou grande circulation). La petite circulation commence avec l’artère pulmonaire qui pénètre dans les poumons où elle se divise en artérioles puis en capillaires pulmonaires. Le sang, après s’être oxygéné passe dans les veines pulmonaires pour parvenir dans l’oreillette gauche, puis le ventricule gauche. De là débute la grande circulation qui achemine le sang jusqu’aux tissus où a lieu la respiration cellulaire. Le déchet produit, le CO2, est transporté par les veines jusqu’au cœur puis passe dans la circulation pulmonaire de manière à être éliminé de l’organisme (figure 1).

Les quatre temps nécessaires à l’accomplissement de la respiration sont :
- La ventilation ou respiration pulmonaire, permettant le renouvellement de l’O2 et le rejet du CO2 ;
- Passage des gaz de l’alvéole au sang ;
- Le transport des gaz par le sang ;
- La respiration cellulaire pendant laquelle la cellule utilise l’oxygène et rejette le CO2.
La ventilation
Voies aériennes et volumes pulmonaires :
L’air capté par le nez traverse le larynx puis la trachée qui se divise en deux bronches souches, lesquelles se subdivisent en bronches lobaires puis segmentaires. Ce processus se poursuit jusqu’aux bronchioles terminales qui sont les plus petites voies aériennes dépourvues d’alvéoles (figure 2).
L’ensemble forme les voies aériennes de conduction. Leur fonction est de purifier, d’humidifier, de réchauffer l’air inspiré et de l’amener jusqu’aux régions d’échanges gazeux du poumon. Les voies aériennes de conduction ne comportent pas d’alvéoles et donc ne participent pas aux échanges gazeux. Elles constituent l’espace mort anatomique, dont le volume est d’environ 150 ml. Les bronchioles terminales se divisent en bronchioles respiratoires présentant quelques alvéoles qui font saillie sur leurs parois. Viennent enfin les canaux alvéolaires qui débouchent sur un sac appelé acinus. Cette région alvéolisée des poumons où se produisent les échanges gazeux est appelée zone respiratoire. La surface d’échange gazeux est comprise entre 50 et 100 m². Les alvéoles sont le siège des échanges gazeux entre l’air et le sang circulant. Elles sont recouvertes à l’intérieur par un film très fin appelé le surfactant. Ce dernier évite le collapsus des alvéoles à l’expiration et facilite les échanges gazeux. La surface externe des alvéoles est tapissée par les capillaires pulmonaires, qui viennent de l’artère pulmonaire (sang non oxygéné). Les volumes pulmonaires peuvent être étudiés au moyen d’un spiromètre qui permet de visualiser l’amplitude et la fréquence des cycles respiratoires d’un individu (figure 3).
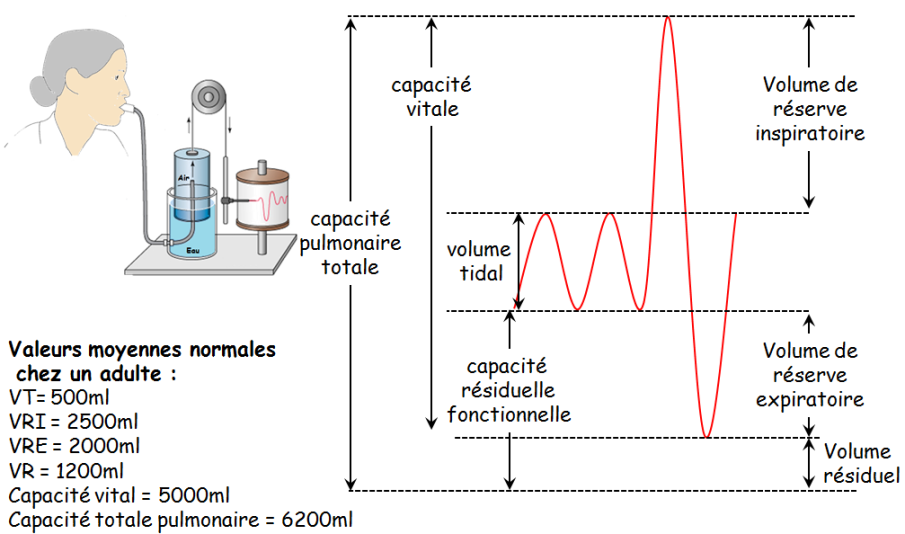
- Fréquence respiratoire moyenne au repos (FC) : 14/mn.
- Volume courant (VC) : Volume d’air inspiré et expiré à chaque respiration normale.
- à VC moyen = 500 ml
- VC/minute = VC x FC = 7 l / min.
- Volume de réserve inspiratoire (VRI) : Volume d’air supplémentaire inspiré après une inspiration normale.
- à VRI = 2500 à 3000 ml
- Volume de réserve expiratoire (VRE) : Volume d’air supplémentaire expiré après une expiration normale.
- à VRE = 1000 à 1200 ml
- Capacité vitale (CV) : Volume maximum d’air mobilisable.
- à CV = 4000 à 4500 ml
- Volume résiduel (VR) : Volume d’air restant après une expiration forcée.
- à VR = 1000 à 1500 ml
- Capacité pulmonaire totale (CPT) : CPT = CV + VR = 5000 à 6000 ml
- Capacité résiduelle fonctionnelle (CRF) : Volume d’air demeurant dans les poumons après une expiration normale.
- à CRF = 2000 à 2500 ml
- VEMS : Volume d’Air Maximal pouvant être expiré en une seconde.
Mécanique ventilatoire
La mobilisation de la cage thoracique et des poumons s’effectue grâce à la contraction des muscles respiratoires : le diaphragme, les muscles intercostaux, les muscles respiratoires accessoires, les muscles abdominaux.
- le diaphragme : le diaphragme est une cloison musculo-aponévrotique, séparant la cavité thoracique de la cavité abdominale, constitué de deux hémicoupoles (figure 4).
Il contient deux parties : une partie musculaire périphérique et une partie tendineuse centrale qui s’insère (figure 5) :
- en avant sur la xiphoïde sternale ;
- latéralement sur les six dernières côtes ;
- en arrière sur les vertèbres lombaires L1-L2-L3.

Figure 4 : le diaphragme 
Il est innervé par le nerf phrénique. Sa contraction augmente le diamètre vertical de la cage thoracique (par abaissement des coupoles) et le diamètre horizontal (par refoulement des côtes inférieures en haut et en dehors).
Donc, lors de l’inspiration, le volume de la cage thoracique augmentant, la pression alvéolaire diminue (d’après la loi de Boyle-Mariotte : Pression x Volume = Constante).
Or, les gaz s’écoulent des zones de hautes pressions, vers les plus basses pressions.
Cela crée donc un afflux d’air vers les poumons.
Lors de l’expiration, le phénomène inverse se produit.
- Les muscles intercostaux (figure 6) :
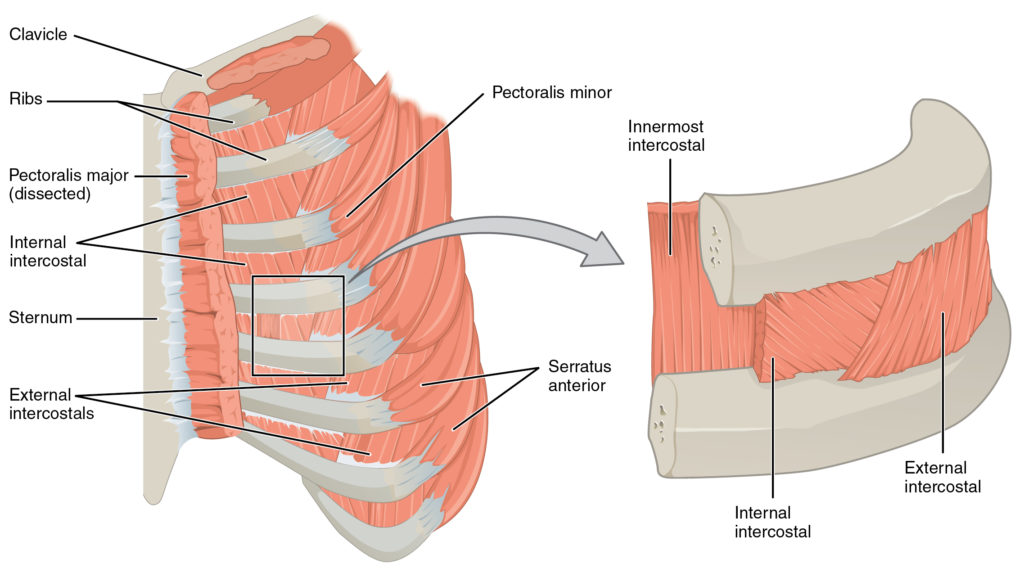
Par OpenStax — https://cnx.org/contents/FPtK1zmh@8.25:fEI3C8Ot@10/Preface, CC BY 4.0, https://commons.wikimedia.org/w/index.php?curid=30131689
La contraction des muscles intercostaux externes entraîne une projection des côtes vers le haut et vers l’avant et donc une augmentation des diamètres transversal et antéropostérieur du thorax.
La contraction des muscles intercostaux internes entraîne un abaissement des côtes et donc une diminution du diamètre latéral du thorax. Ils interviennent uniquement lors de l’inspiration forcée.
Muscle Sterno-cleïdo-mastoïdiens 
M. scalènes (antérieur, médian & postérieur)

M. petit pectoral 
M. grand pectoral 
M. trapèze 
M. grand dentelé 
M. sous-clavier
Les muscles abdominaux sont constitués par :
- les transverses de l’abdomen ;
- les obliques externes et internes ;
- les grands droits.
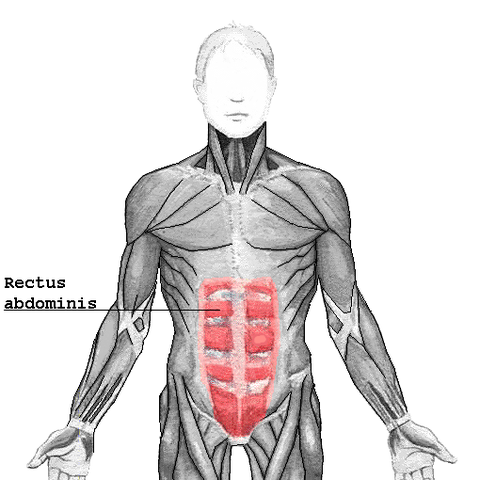
M. grand droit 
M. oblique externe 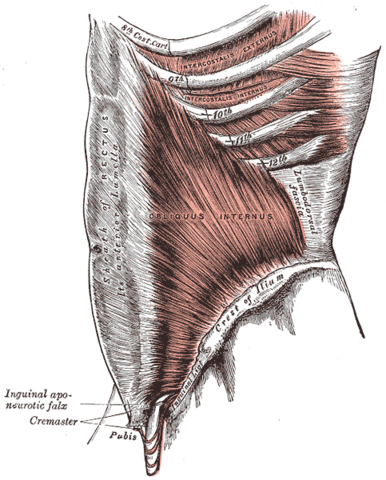
M. oblique interne 
M. transverse de l’abdomen
Ce sont des muscles expiratoires mis en jeu lors d’une expiration forcée.
Leur contraction entraîne une diminution du diamètre vertical du thorax (par compression des viscères qui refoulent le diaphragme vers le haut) et une diminution du diamètre latéral (par abaissement des côtes inférieures).
Au total,
- En respiration calme :
- L’inspiration est active, les muscles mis en jeu sont le diaphragme (muscle principal) et les intercostaux externes des espaces intercostaux supérieurs. Le centre du diaphragme s’abaisse de 1 à 2 cm et la circonférence au niveau de la xiphoïde sternale augmente de 1 cm.
- L’expiration résulte d’une restitution passive de l’énergie élastique emmagasinée pendant l’inspiration.
- En hyperventilation (figure 9a & 9b) :
- Lors de l’inspiration, on observe :
- une augmentation de l’amplitude et de la fréquence des muscles inspiratoires ;
- le centre du diaphragme s’abaisse de 10 cm et tous les muscles intercostaux sont mis en jeu ;
- un recrutement des muscles inspiratoires accessoires ;
- l’augmentation du diamètre antéropostérieur est de 3,5 cm, celle du diamètre latéral de 3 cm.
- L’expiration devient active : les muscles intercostaux externes et les abdominaux (muscles principaux) se contractent.
- Lors de l’inspiration, on observe :
Contrôle de la ventilation pulmonaire
Les valeurs moyennes des gaz du sang artériel sont :
- Pa O2 = 85 à 100 mm Hg
- PaCO2 = 35 à 40 mm Hg
Le maintien d’une PO2 et PCO2 artérielle à l’intérieur de ces limites étroites est normalement possible grâce à un contrôle précis du niveau de ventilation, dont les trois éléments de base sont :Les récepteurs qui recueillent l’information et la fournissent aux centres de contrôle situés dans le cerveau, qui coordonnent cette information et, en retour, envoient des impulsions aux effecteurs (muscles respiratoires) qui assurent la ventilation.
Les récepteurs
Les chémorécepteurs centraux
situés sur la face ventrale du bulbe, leur fonction est de maintenir constant le PH du LCR. Lorsque la PCO2 du sang augmente, le CO2 diffuse dans le LCR à partir des vaisseaux cérébraux, libérant des ions H+ qui stimulent les chémorécepteurs. Il en résulte une hyperventilation réactionnelle. Le CO2 agit sur ces centres respiratoires bulbaires pour des pressions partielles supérieures à 30 mm Hg La réponse est assez lente (quelques minutes).
Les chémorécepteurs périphériques
Ils sont situés dans les corpuscules carotidiens, à la bifurcation des artères carotides communes, et dans les corpuscules aortiques au-dessus et en dessous de la crosse de l’aorte. Ils répondent à la diminution de la PO2 artérielle et dans une moindre mesure, à l’augmentation de la PCO2. La relation entre la fréquence de décharge et la PO2 artérielle n’est pas linéaire : la réponse est relativement faible jusqu’à ce que la PaO2 soit abaissée au-dessous de 100 mm Hg La réponse maximale se produit pour une PaO2 < 50 mm Hg ; les chémorécepteurs périphériques sont responsables de la totalité de l’augmentation ventilatoire qui survient chez l’homme en réponse à une hypoxémie artérielle.
Le stimulus CO2 agit sur ces récepteurs périphériques lorsque la PaCO2 est > 40 mm Hg.
Cette réponse réflexe est rapide (quelques secondes) mais elle est bloquée pour une PaO2 > 200 mm Hg.
Au total, la PCO2 du sang artériel est le facteur le plus important dans le contrôle de la ventilation. Par exemple, pour une PaO2 normale, la ventilation augmente d’environ 2 à 3 litres pour chaque élévation de 1 mm Hg de la PaCO2. Pour des valeurs normales de capnie, la PaO2 peut être réduite au voisinage de 50 mm Hg avant qu’aucune augmentation appréciable de la ventilation ne survienne. Un abaissement de la PCO2 artérielle est très efficace pour réduire le stimulus de ventilation ; c’est pour cette raison que l’hyperventilation est parfois pratiquée en apnée.
Les effets combinés des deux stimuli (PaO2 et PaCO2) dépassent la somme des effets de chacun appliqués séparément : ils se potentialisent.
Les récepteurs pulmonaires à l’étirement
Ils se situent dans les muscles lisses des parois des voies aériennes. Les impulsions transitent par le nerf vague. L’inflation des poumons tend à inhiber toute activité musculaire inspiratoire supplémentaire ; la déflation des poumons tend à déclencher l’activité inspiratoire : c’est le réflexe de Hering-Breuer.
Ainsi en apnée, il convient de ne pas réaliser une inspiration maximale avant l’immersion afin de ne pas favoriser ce réflexe de déflation.
Autres récepteurs :
- Les récepteurs articulaires et musculaires : lors de l’exercice musculaire, leur stimulation contribue à l’apparition d’une polypnée et d’une hyperpnée, permettant l’adaptation de la ventilation au travail à fournir.
- Fuseaux neuromusculaires : contenus dans les muscles intercostaux et le diaphragme, ils sont sensibles à l’élongation. Cette information est utilisée pour contrôler par voie réflexe la force de contraction.
- Récepteurs cutanés : l’excitation des nerfs sensitifs cutanés (par la douleur, les variations de température) est à l’origine de modifications de la respiration. Ainsi, l’emploi de frictions et l’application d’eau froide sont utilisés pour activer la respiration des sujets en syncope.
Les centres de contrôle
- Le tronc cérébral : des noyaux situés dans le pont et le bulbe assurent le processus automatique de la respiration. Le système oscille de façon rythmique entre inspiration et expiration.
- Le Cortex : La respiration est certes un acte involontaire mais elle est réalisée par des muscles squelettiques, dont l’activité peut être modulée par un contrôle volontaire du cortex, sur le rythme et l’amplitude de la ventilation. Le contrôle du cortex peut surpasser, dans certaines limites, la fonction du tronc cérébral. Ainsi la PCO2 artérielle peut être réduite de moitié par une hyperventilation.
- D’autres régions du cerveau, comme l’hypothalamus ou le système limbique, peuvent intervenir dans le contrôle de la respiration au cours de certains états affectifs.
Les effecteurs :
Ce sont les muscles respiratoires décrits précédemment.
La ventilation
La pression de l’air atmosphérique est de 760 mm Hg.
Composition de l’air atmosphérique :
- Azote (N) = 79 %, soit 600 mm Hg*
- O2 = 21 %, soit 159 mm Hg
- CO2 = 0,03 %, soit 0,3 mm Hg
* D’après la loi de Dalton : la Pression partielle est la pression exercée par ce gaz dans le mélange = % x Pression totale.
Le transfert des gaz entre l’alvéole, le sang et la cellule se fait par diffusion passive dans un sens imposé par le gradient de leur pression partielle et jusqu’à ce que l’état d’équipression soit atteint. (tableau I)
| air sec | voies aériennes | gaz alvéolaire | sang artériel | sang veineux | |
| PpO2 (mm Hg) | 159 | 149 | 105 | 100 | 40 |
| PpCO2 (mm Hg) | 0,3 | 0,3 | 40 | 40 | 46 |
(Cours de physiologie respiratoire, Université de Grenoble)
Le sang quitte le cœur gauche avec une PO2 = 100 mm Hg et une PCO2 = 40 mm Hg, puis il arrive aux tissus où il libère l’oxygène. Le sang repart des tissus avec toutes les caractéristiques d’un sang veineux, soit PO2 = 40 mm Hg et PCO2 = 46 mm Hg (Figure 10).
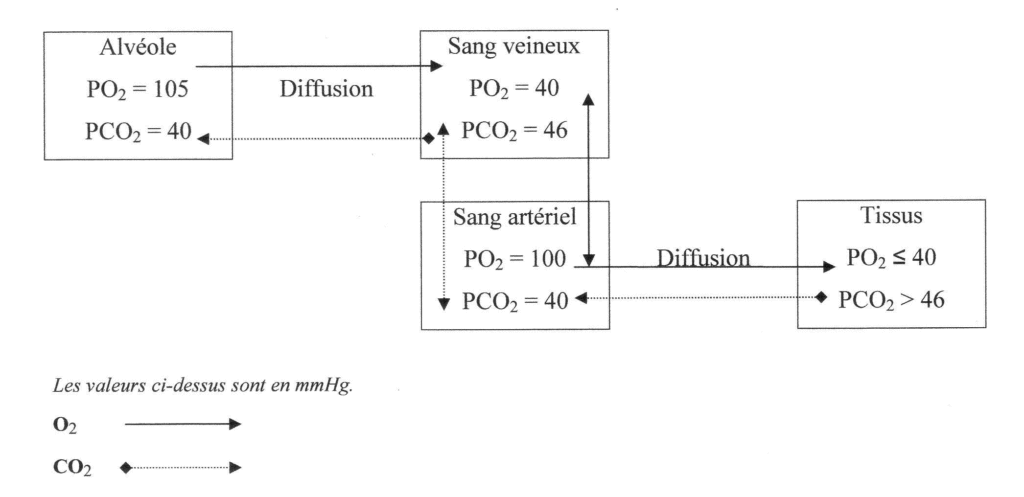
Transport des gaz par le sang
L’oxygène
L’O2 est transporté dans le sang sous deux formes : dissous et combiné à l’hémoglobine.
- Fraction dissoute : selon la loi de Henry, elle est proportionnelle à la pression partielle d’O2. (Loi de Henry : Volume des gaz dissous = Coefficient de solubilité du gaz x Pgaz/ Patm). Elle représente 2 à 5 % de l’O2 sanguin.
- Fraction combinée : la plus grande partie de l’O2 sanguin (95 à 98 %) forme une combinaison aisément réversible avec l’hémoglobine pour donner l’oxyhémoglobine : O2 + Hb ó HbO2 (figure 11).

Cette courbe représente la variation de la saturation de l’hémoglobine en O2 en fonction des différentes valeurs de la PaO2. Nous constatons que cette courbe n’est pas linéaire et que des variations importantes de la saturation en O2 (SaO2) ne sont mesurables qu’à partir de valeurs de PaO2 inférieures à 50 mm Hg Si la PaO2 dépasse 120 mm Hg, l’hémoglobine se sature progressivement en O2 jusqu’à une certaine limite au delà de laquelle son pouvoir oxyphorique se trouve dépassé. Le surplus d’O2 ne pourra dès lors être stocké que sous forme dissoute.
L’affinité de l’hémoglobine pour l’O2 est diminuée par augmentation de :
- Température.
- H+ (donc diminution du PH)
- CO2 (effet Bohr).
- 2,3 Diphosphoglycérate (métabolite de la glycolyse anaérobie intra-érythrocytaire).
Cette diminution d’affinité entraînera une augmentation de la libération d’O2. [39]
2. le dioxyde de carbone :
- Fraction dissoute : le CO2 obéit, comme l’O2 à la loi de Henry, mais il est 20 fois plus soluble que l’O2. Ainsi, la fraction dissoute représente le dixième de la quantité totale de CO2. [71]
- Fraction combinée :
- Sous forme de tampons (60 % du CO2 total) : [acide carbonique – bicarbonates] selon la réaction suivante : CO2 + H2O « H2CO3 « [H+] + [HCO3‾]
- Sous forme de carbaminohémoglobine : Plus la saturation de l’hémoglobine en O2 est basse, plus la fixation du CO2 par l’hémoglobine est importante : c’est l’effet Haldane.
Références :
- LAUNOIS – ROLLINAT S. – Physiologie du système respiratoire. Laboratoire du sommeil, CHU Grenoble. Janvier 2006. http://www-sante.ujf-grenoble.fr/SANTE/alpesmed/physiorespi/
- RAMONATXO C. – Déterminants cardio-respiratoires de la performance sportive. UFR STAPS, Université Montpellier 1, année 2005-2006. http://www.staps.univ-montp1.fr/enseignants/Ramonatxo/Determinants-perf-1-2.pdf
- WEST J.B. – La physiologie respiratoire, 6e édition, Maloine, Paris, 2003, 221 p.



